Arachnoïdite
Résumé du Professeur Antonio Aldrete (U.S), lien : Arachnoidite par le Pr aldrete
L'arachnoïdite périmédullaire : Une complication tardive et sévère de l'analgésie péridurale
L'arachnoïdite est une complication de la péridurale, sûrement sous-estimée car survenant après un long délai par rapport à l’anesthésie. Nous rapportons deux cas survenus après une analgésie péridurale et nous faisons une revue des cas rapportés dans la littérature. La présentation clinique n’est pas spécifique, elle associe des troubles sensitifs, moteurs et sphinctériens d’apparition progressive.
L’imagerie par résonance magnétique permet en général de faire le diagnostic. Le pronostic fonctionnel est mauvais avec souvent un handicap séquellaire important. La chirurgie ne semble pas apporter de bénéfice.
Le mécanisme de l’arachnoïdite post-péridurale est controversé : il semble s’agir d’une réaction immunologique déclenchée par les anesthésiques qui peut s’étendre de façon chronique.
L'anesthésie péridurale est une technique d’analgésie opératoire très couramment utilisée, efficace et sûre. Néanmoins comme toute procédure médicale, elle peut entraîner des complications. L’incidence de ses complications neurologiques est estimée globalement à 1/10000 (1). Mais, ces chiffres peuvent varier d’un auteur à l’autre en raison de l’imprécision du terme « complications neurologiques ». Les déficits neurologiques sévères sont rares.
Ces accidents peuvent être dus à un traumatisme direct de la moelle ou des racines nerveuses, à une complication vasculaire (hématome rachidien, ischémie médullaire), à une complication infectieuse (abcès ou
méningite), ou à la neurotoxicité des agents injectés déclenchant des arachnoïdites dites « chimiques ».
Nous rapportons ici deux cas d’arachnoïdite survenue à distance d’une péridurale et nous discutons du mécanisme,
de la clinique, de l’aspect radiologique et du pronostic de cette affection plutôt rare et méconnue
parmi les complications neurologiques post-péridurale. Les périmédullaires peuvent survenir dans les suites de procédures diagnostiques ou thérapeutiques qui nécessitent l’introduction de substances étrangères dans les espaces sous-arachnoïdiens. Différents agents ont été incriminés comme le produit de contraste utilisé dans les myélographies, les médicaments comme les corticoïdes ou la pénicilline, le sérum antitétanique ou des produits
anesthésiants (3). Elles peuvent aussi s’observer au décours d’une méningite ou d’une chirurgie médullaire. Enfin dans certains cas, on ne retrouve pas de cause (4). Les arachnoïdites surviennent en général dans un délai
de quelques mois à quelques années (jusqu’à 12 ans) après la péridurale (4). Dans nos deux cas, ce délai était respectivement de 3 mois à 8 ans. Le mécanisme le plus souvent retenu dans l’origine de cette arachnoïdite est une réaction allergique aux produits introduits (6). Il pourrait s’agir d’une réaction aux détergents utilisés pour la désinfection des instruments d’anesthésie comme cela a été reproduit expérimentalement chez l’animal où l’on a pu déclencher des arachnoïdites chimiques après injection épidurale de détergents (3). Les solutions anesthésiques vasoconstrictrices ont été également incriminées. Elles peuvent contenir des conservateurs comme le métabisulfite ou le méthylparaben (1), ces produits dont on ne connaît pas la toxicité neurologique entraînent des dermatoses sévères lorsqu’on les utilise dans les préparations à usage cutané (3).
Il ne semble pas nécessaire d’injecter le produit dans l’espace sous-arachnoïdien pour obtenir une arachnoïdite.
Le produit peut diffuser à travers la dure-mère et le long des gaines radiculaires (4). L’expérimentation animale a montré que lesdrogues anesthésiques sont retrouvées dans le liquide céphalo-rachidien après péridurale sans qu’il n’y ait de brèche méningée (3). Quelque soit leur étiologie, le tableau clinique de ces arachnoïdites est identique et très polymorphe. Les premiers signes sont des troubles sensitifs avec des dysesthésies, des brûlures, des sensations de striction. Dans des délais variables, apparaissent des difficultés à la marche et des troubles sphinctériens. Cette aggravation est lentement progressive et va aboutir à une paraplégie plus ou moins complète ou un syndrome de la queue de cheval (1). Notre premier cas est assez conforme aux données de la littérature avec une paraplégie s’installant rapidement en 3 mois alors que dans le second cas, la symptomatologie est plus frustre, et se résume à une
radiculalgie et des troubles urinaires. L’imagerie par résonance magnétique est l’examen le plus performant pour faire le diagnostic d’arachnoïde périmédullaire. Dans certains cas, la myélographie et le scanner peuvent être nécessaires en complément diagnostic (7). Il n’existe pas de signes radiologiques spécifiques dans les formes post-péridurales.
Cependant les lésions sont volontiers plus étendues le long de la moelle que dans les autres étiologies (4).
L’examen montre une moelle fine de contours irréguliers en raison des adhérences arachnoïdiennes (4). On
peut observer des kystes arachnoïdiens qui compriment la moelle ainsi qu’une prise de contraste méningée et les racines peuvent apparaître irrégulières, épaissies, mal individualisées (7). Il faut rapporter des cas fréquents de syringomyélie secondaire à l’inflammation des méninges qui entraîne une cicatrice au niveau de l’arachnoïde avec une vasoconstriction locale, puis une ischémie médullaire, et une nécrose aboutissant à un kyste qui va s’étendre réalisant une forme syringomyélique (8). S’il existe quelques cas d’amélioration spontanée (8, 9), le pronostic de l’arachnoïdite post-péridurale est en général mauvais avec des séquelles fonctionnelles importantes (3, 4, 6). Il semble que la réaction inflammatoire ne reste pas toujours confinée à un étage médullaire, mais qu’elle puisse se propager à toute la moëlle entretenue par une réponse immunitaire persistante subaigüe voire chronique (4). Elle peut même atteindre le cerveau et des nerfs crâniens (6). Dans la littérature, les cas d’arachnoidite post-péridurale opérés sont rares (7 ,8 ,9 ,10), probablement en raison de l’extension fréquente des lésions le long de la moëlle rendant la chirurgie difficile (4). Il peut y avoir des améliorations post-opératoires (8, 9), comme c’est le cas pour notre deuxième patiente. Mais souvent, il y a ensuite une réaggravation neurologique (9, 10), comme si la réaction inflammatoire continuait à évoluer pour son propre compte. C’est ce qui s’est produit pour notre première patiente avec à l’imagerie apparition d’un nouveau kyste arachnoïdien compressif témoignant de l’évolutivité
du processus. Enfin, dans certains cas, la chirurgie n’apporte aucune amélioration neurologique (8, 9).
Dans la littérature, peu d’alternatives thérapeutiques à la chirurgie sont proposées : dans la majorité des cas, il y a eu abstention thérapeutique (3, 4, 6). Néanmoins, on peut rapporter un cas intéressant de chirurgie suivie d’une aggravation neurologique en post-opératoire ayant régressé sous médication anti-inflammatoire(10).
Conclusion
L’arachnoïdite post-péridurale est souvent responsable de troubles neurologiques importants avec un tableau de compression médullaire ou de syndrome de la queue de cheval. Le délai d’apparition des signes est variable allant de quelques mois à quelques années rendant parfois le diagnostic difficile. L’imagerie médullaire par résonance magnétique permet de visualiser l’arachnoïdite. Le pronostic est en général mauvais avec des séquelles neurologiques importantes. Dans la majorité des cas, la chirurgie ne permet pas d’améliorer l’état clinique. Il y a peu d’alternatives thérapeutiques rapportées dans la littérature, où l’abstention thérapeutique est souvent de règle. On peut néanmoins relater un cas intéressant d’amélioration sous médication-inflammatoire.
Sources : 1- Pujol S, Torrielli R. (1996). Accidents neurologiques après anesthésie péridurale en milieu obstétrical.
Cahiers d’anesthésiologie 44 (4) : 341-345.
2- Aromaa U, Ladhensuu M, Cozanitis DA. (1997) Severe complications associated with epidural and
spinal anaesthesias in inland 1987-1993. A study
La ponction lombaire peut entraîner une infection, une arachnoïdite. Elle n'est pas sans risque.
Schéma
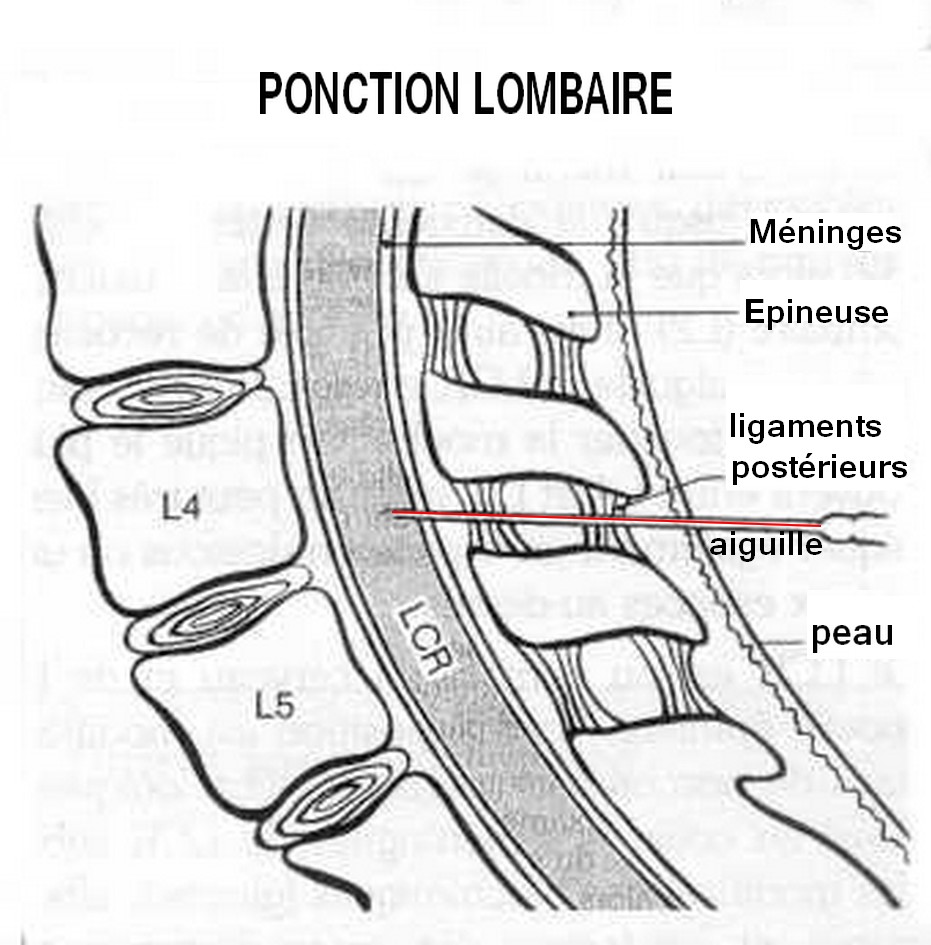
Les Risques cachés de la péridurale.
http://hekate.fr/wp-content/uploads/2011/05/LesRisquesCachesDeLaPeridurale-Buckley.pdf
Les Risques des injections épidurales de stéroïdes et transforaminales dans la colonne vertébrale
Complication de l'arachnoïdite et kystes arachnoïdiens
ARACHNOIDITE : DIAGNOSTIC ET TRAITEMENT par le Dr Forest Tennant M.D., Dr. P.H.
Article préparé pour la prise en charge de la douleur
RÉSUMÉ: L'arachnoïdite a été traditionnellement considérée comme une pathologie rare et incurable mais elle émerge à présent comme une entité relativement courante, pouvant être traitée.
INTRODUCTION L'arachnoïdite est une pathologie neuro-inflammatoire évolutive.1-3 Bien qu'ayant été reconnue, il y a de nombreuses années, elle a, depuis, été considérée comme une maladie rare et enregistrée sur le "Registre des Maladies Rares". 2,3 De nos jours, son incidence et sa prévalence semblent augmenter et les spécialistes de la douleur à travers tout le pays sont maintenant confrontés à des cas.
Bien que le terme arachnoidite implique seulement une inflammation de la paroi arachnoïde des méninges ou du sac dural, l'anomalie pathologique majeure, dans la majorité des cas, réside dans la neuro-inflammation des racines nerveuses de la cauda equina 4-8 (queue de cheval). Une fois que les microglies des racines nerveuses produisent une neuro-inflammation, elles peuvent entraîner la formation d'adhérences et de cicatrices qui peuvent amener les racines nerveuses à s'agglutiner entres elles ou à se regrouper en amas pour ensuite adhérer à la paroi de l'arachnoïde9-13. Le terme d'arachnoïdite adhésive (AA) est l'expression historiquement assignée pour désigner la pathologie durant laquelle les adhérences ou le tissu cicatriciel présents entre les racines nerveuses ou/et la paroi de l'arachnoïde sont visibles par imagerie à Résonnance Magnétique (IRM).2-12 L'abréviation AA sera utilisée tout au long de l'article puisqu'il s'agit du stade de la pathologie qui pousse le patient à rechercher un traitement de la douleur approprié.
Bien que la neuro-inflammation et la formation des adhérences se résolvent naturellement pour quelques patients, l'AA peut être une maladie invalidante, évolutive et douloureuse au caractère très sévère. 6,14-17 Elle peut évoluer vers une paralysie des extrémités inférieures ainsi que vers des dysfonctionnements vésicaux, intestinaux et gastro-intestinaux, vers une incapacité à tenir une position assise ou une position debout, vers une détérioration des capacités mentales et vers une pathologie auto-immune avec des symptômes pouvant imiter les pathologies rhumatoïdes classiques.3
Au cours des 5 dernières années, nous avons admis en traitement un nombre croissant de patients atteints d'arachnoïdite adhésive. Aujourd'hui, nous suivons environ 65 cas. Nous avons passé en revue les IRM de plus de 200 patients pour lesquels le diagnostic a été confirmé. Quelques cas ont été considérés comme étant des urgences puisque ces patients ont développé des douleurs importantes et une paralysie partielle des extrémités inférieures ainsi qu'un dysfonctionnement vésical, immédiatement après une ponction lombaire, une anesthésie en péridurale à l'occasion de la naissance d'un enfant, une infiltration épidurale de corticoïdes stéroïdiens ou une chirurgie. Les protocoles de traitement pour les deux formes d'arachnoïdite, aiguë ou chronique, ont été développés et sont présentés partiellement ici puisque l'AA est maintenant reconnue comme l'une des pathologies nécessitant le recours à une prise en charge de la douleur à travers le pays. Le traitement de l'arachnoïdite aiguë doit débuter très tôt après l’apparition des symptômes, sans quoi une paralysie des extrémités des membres inférieurs s'ensuit de façon irréversible. Mes protocoles sont destinés à être utilisés par des médecins généralistes dans des structures ambulatoires puisque l'auteur pense que les formes aiguës et chroniques de l'arachnoidite doivent être soignées dans chaque communauté. En plus de la reconnaissance et du traitement des cas, il est vivement recommandé aux médecins spécialistes de la douleur de posséder quelques connaissances et une petite expertise dans l'analyse des IRM à la recherche de signes de présence d'arachnoïdite adhésive.
Peu de choses ont été écrites concernant le diagnostic clinique et le traitement de l'arachnoïdite. Beaucoup des données rassemblées ici découlent des observations personnelles de l'auteur, de ses croyances et de ses méthodes puisqu'il existe peu de références permettant d'étayer ces hypothèses dans la littérature médicale.
ANATOMIE DE LA QUEUE DE CHEVAL
La compréhension de l'AA requiert quelques connaissances anatomiques de la queue de cheval. Environ deux douzaines de racines nerveuses émanent et pendent de l'extrémité de la moelle épinière connue sous le nom de conus medullaris. 18,19 (Figure 1). Les racines nerveuses à l'intérieur du sac dural sont assez organisées. Elles sont d'abord situées à la portion postérieure du sac dural entre L1 et L3 et ensuite se déplacent en avant ou en arrière. (Figures 2 et 3) Les racines nerveuses sortent progressivement du sac dural, commençant entre L1 et L3. Les racines nerveuses de la queue de cheval sont constamment baignées et submergées dans le liquide céphalo-rachidien qui agit comme un lubrifiant, permettant de prévenir les frictions entre les nerfs, qui transporte les déchets et qui achemine des nutriments jusqu'aux racines nerveuses.20-24 Le liquide céphalo-rachidien se renouvelle environ quatre fois par jour.20 Les déchets, y compris les particules inflammatoires provenant des racines nerveuses enflammées, sont portés jusqu'en haut pour s'écouler à travers des canaux méningés, dans les ganglions lymphatiques cervicaux et la circulation sanguine globale.21-23 Des changements pathologiques dans les racines nerveuses peuvent être visualisés au mieux par la taille et le placement dans le plan axial d'un IRM de contraste. (Figures 2-4).18 Les racines nerveuses enflammées sur un plan axial apparaissent gonflées (en proie à l'œdème, déplacées par rapport à leur position normale et collées ou agglutinées les unes aux autres. (Figure 3,4)
SYNDROME DE LA QUEUE DE CHEVAL
Bien décrit dans la littérature scientifique, il existe le syndrome de la queue de cheval. Ce diagnostic est posé quand un tissu anatomique, le plus souvent un disque intervertébral ou des vertèbres effondrées, compresse de manière aiguë les racines nerveuses de la queue de cheval. Un traumatisme sévère, aigu comme un accident de voiture ou de ski, est normalement l'événement déclencheur de ce syndrome. Quand une compression de la queue de cheval survient, il s'agit d'une urgence de chirurgie neurologique puisque l'on doit procéder à la libération des racines nerveuses afin de prévenir les paraparésies des extrémités inférieures, la paralysie, l'apparition de lésions vésicales ou intestinales et l'apparition de douleurs sévères.
Bien que le terme Syndrome de la queue de cheval fasse référence traditionnellement à la compression aiguë des racines nerveuses, quelques praticiens utilisent maintenant le terme "Syndrome Chronique de la Queue de Cheval", quand des dysfonctionnements vésicaux, intestinaux, de la douleur et une paralysie partielle coexistent. Pour autant que cet auteur puisse le déterminer, le "syndrome de la queue de cheval chronique" n'est pas du à une compression des racines nerveuses mais désigne en vérité une neuro-inflammation des racines nerveuses de la queue de cheval. En fait, il s'agit d'un nom différent permettant de désigner l'arachnoïdite adhésive.
L' ÉVÉNEMENT DÉCLENCHEUR : IRRITATION ET NEURO-INFLAMMATION
L'AA se rencontre tout d'abord dans la colonne lombo-sacrée bien qu'elle puisse survenir dans les régions cervicales et thoraciques de la colonne vertébrale.7,9,10,16,17,25 Aux temps modernes, le diagnostic d'AA a été seulement établi lorsque sur les images de l'IRM, on constate que les racines nerveuses ont formé entre elles des adhérences, formant des agglutinations ou/et lorsque l'adhérence à la paroi de l'arachnoïde est provoquée par les adhérences.5-11 L'AA peut être déclenchée par un irritant qui peut affecter quelques-unes parmi les 2 douzaines de racines nerveuses présentes dans la queue de cheval.14,26 Les agents irritants peuvent aller de la toxine à la friction entre les racines nerveuses en passant par le traumatisme ou l'infection.4,10,12,15,26 Dès que l'irritation survient dans les racines nerveuses, les cellules microgliales activées initient une réponse neuro-inflammatoire.27-29 Comme toute inflammation, une quantité modeste est protectrice et curative mais une inflammation trop importante entraîne une destruction tissulaire avec des éléments adhérents et provenant du tissu cicatriciel.
Des pathologies courantes de la colonne vertébrale, y compris les hernies discales, la sténose dorsale et l'arthrite dégénérative peuvent entraîner une irritation assez importante pour produire une neuro-inflammation dans les racines nerveuses de la queue de cheval. En dépit des propriétés lubrifiantes du liquide céphalo-rachidien, les déformations de la colonne vertébrale et ses déséquilibres provoqués en cas de scoliose, de kystes ou d'arthrite, peuvent provoquer une compression et une friction assez importantes entre les racines nerveuses pour provoquer une irritation, l'activation des cellules microgliales et une neuro- inflammation.
Les traumatismes des actes médicaux, y compris l'injection para spinale et la chirurgie qui sont indiquées médicalement peuvent laisser derrière eux en guise de complication l'arachnoïdite adhésive.4,6,15,17,25,26 Bien que le pourcentage soit inconnu, de nombreux patients ayant reçu l'étiquette de syndrome de "l'échec d'une chirurgie dorsale" sont susceptibles d'être atteints d'AA et devraient faire l'objet d'une évaluation permettant de dépister cette pathologie.
EVOLUTION PATHOLOGIQUE
Malheureusement, l'AA peut se développer, se renforcer et devenir une pathologie évolutive invalidante et neuro-inflammatoire.2,3,7,10,11,13 Les racines nerveuses enflammées et la paroi de l'arachnoïde peuvent s'enflammer progressivement et ajouter ou capturer les racines nerveuses situées à proximité. L'évolution peut se faire de manière ascendante ou descendante le long de la colonne vertébrale. Par exemple, ce qui peut débuter sous forme d'une douleur légère avec quelques troubles vésicaux ou intestinaux et de légères céphalées, peut évoluer vers une incapacité à uriner sans cathéter et une paralysie des membres inférieurs. Un nombre significatif de patients atteints d'AA sont venus me consulter pour des douleurs à un stade avancé de la pathologie. Ils avaient déjà atteint le stade de la pathologie auquel un déambulateur ou un fauteuil roulant deviennent nécessaires pour les déplacements. Quelques patients présentant des cas sévères, étaient tellement algiques, fatigués et handicapés qu'ils passaient 80 à 90 % de leur temps au lit. La douleur peut être si puissante que des opioïdes à haute dose sont nécessaires, ne serait-ce que pour la maîtrise de la douleur la plus modeste qui soit.
Bien que le mécanisme soit quelque peu imprécis, des patients peuvent apparemment contracter une interférence avec le liquide céphalo-rachidien.20,24 A mon avis, la cause réside dans le fait que l'agglutination des racines nerveuses, la formation de tissu cicatriciel et les adhérences forment un "blocage de voie" physique pour le liquide céphalo-rachidien. Quel qu'en soit le mécanisme, les patients peuvent développer un trouble périodique de la vision et des céphalées sévères dues à une augmentation de la pression du fluide.2 Des lésions et une détérioration des aptitudes mentales relatives à la capacité attentionnelle, à la capacité de mémorisation, à la pensée logistique ou abstraite et même aux aptitudes relatives à la lecture et à l'écriture peuvent survenir. Quelques patients atteints d'AA au stade avancé développent une telle invalidité physique et mentale que leur état nécessite une prise en charge et des soins constants. 2,3,10-13
Les patients contractent à une prévalence élevée des formes d'arthralgie, de myalgie et des phénomènes auto-immuns comme la thyroïdite d'Hashimoto et le syndrome du canal carpien. 2,10,11,13 Bien que le mécanisme de développement des symptômes auto-immuns soit inconnu, une explication plausible est le drainage des cellules et des antigènes solubles du liquide céphalo-rachidien dans les ganglions lymphatiques régionaux.21-23 L'un des buts majeurs du traitement consiste à stopper l'évolution, le caractère invalidant et la détérioration caractéristique des patients souffrant d'AA.
DIAGNOSTIC : SYMPTÔMES ET SIGNES
Les patients souffrant d'AA présentent des signes et des symptômes typiques qui permettent à un praticien d'identifier un patient atteint d'AA parmi un groupe de patients souffrant de douleurs dorsales (Tableau 1).30 En plus de la douleur constante, plus de 90 % des patients atteints d'AA se plaignent de : (1) dysfonctionnements vésicaux ou intestinaux ; (2) incapacité à rester en position debout plus de quelques minutes ; (3) sensations de brûlures plantaires ; (4) épisodes de vision trouble ; (5) céphalées ; (6) douleur qui lacère ou qui lance dans les jambes ; et (7) sensations étranges sur la peau (ex. des insectes qui rampent, de l'eau qui tombe ou des épingles qui piquent).
Selon l'expérience de l'auteur, l'incapacité à se tenir debout pendant un long laps de temps domine tellement le tableau clinique de ces patients qu'ils peuvent même vous demander à s'allonger sur la table d'examen ou sur le sol de votre bureau. Les troubles vésicaux sont essentiellement universels. Les patients peuvent présenter différents troubles, y compris un retard de la miction, une incontinence, une urgence à uriner et la sensation que leur vessie est remplie. Pour les cas sévères, les patients doivent se sonder eux-mêmes pour initier la miction. Quelques signes physiques se manifestent toujours. Ils peuvent comprendre une faiblesse des extrémités des membres inférieurs, une hypo-réflexie et une démarche anormale. Les patients peuvent être incapables d'effectuer des mouvements simples tels que lever les jambes tout en les gardant droites ou des flexions de l'un ou des deux pieds. L'amplitude de l'ensemble des extrémités supérieures et inférieures peut être réduite. Lors de l'observation de leur démarche, doivent être recherche les petits pas, les courbures, un large polygone de sustentation et une instabilité.
MARQUEURS INFLAMMATOIRES
Selon l'expérience de l'auteur, de 30 à 40 % des patients atteints d'AA présentent une vitesse de sédimentation des érythrocytes élevée (VS) ou des taux et une sensibilité élevés à la protéine C réactive (CRP).31,32 Les taux de CRP peuvent être excessivement élevés. D'autres marqueurs inflammatoires moins connus tels que les interleukines, la myéloperoxidase, l'alpha antitrypsine et le facteur de nécrose tumorale peuvent également présenter des taux élevés. 31
La présence de marqueurs inflammatoires élevés est susceptible d'indiquer un processus pathologique plus actif ou sévère mais cela peut ne pas être toujours le cas. La neuro- inflammation (comme l'inflammation articulaire) peut être fluctuante. Elle peut s'accumuler ou se dissiper pour des raisons inconnues qui peuvent ne pas refléter la sévérité de la pathologie. La présence d'une vitesse de sédimentation des érythrocytes ou des taux de CRP élevés suggère, cependant, que l'AA est active et qu'elle nécessite un traitement.32
Que la neuro-inflammation ne puisse jamais être totalement stoppée ou soignée échappe encore à nos connaissances. Considérer que les patients souffrant d'AA ressentent des douleurs constantes et présentent des crises intermittentes suggère que leur douleur englobe continuellement un ensemble de composantes neuro-inflammatoires et neuropathiques.
IMAGERIE PAR RÉSONNANCE MAGNÉTIQUE
La meilleure image par IRM permettant de confirmer un diagnostic d'AA est un plan axial d'un IRM de contraste réalisé aux niveaux des segments vertébraux L-3, 4, 5 et au niveau du S-1 de la colonne lombaire.18,19 L'interprétation de l'IRM se fonde sur la localisation et la taille normales des racines nerveuses internes à la queue de cheval.(Figure 2 et 3) On présente ici des diagrammes représentant les racines nerveuses de la queue de cheval selon leur localisation et leur taille normales. Quand les racines nerveuses s'irritent ou s'enflamment, elles enflent typiquement, se déplacent par rapport à leur position normale, forment des adhérences et s'agglutinent les unes aux autres ou se regroupent en amas.5,7-10 On montre ici des IRM qui présentent les 3 signes typiques de l'inflammation des racines nerveuses : (1) déplacement ; (2) gonflement ; et (3) agglutination. Quelques radiologues mais pas tous vont poser un diagnostic d'arachnoidite en présence de ces 3 signes. Quelques-uns vont seulement diagnostiquer l'AA quand ils mettent clairement en évidence des adhérences entre des racines nerveuses agglutinées et la paroi de l'arachnoïde. Techniquement, lorsque des adhérences à la paroi de l'arachnoïde ne sont pas observées, un diagnostic plus spécifique sera celui de neuro-inflammation de la queue de cheval.
On montre ici (figure 4) quelques exemples de racines nerveuses agglutinées à l'intérieur du canal vertébral ainsi qu'une adhérence à la paroi de l'arachnoïde. L'un des messages les plus importants que je veux faire passer est de ne jamais demander à un radiologue d'interpréter un IRM sans les antécédents cliniques. On devra envoyer au radiologue un résumé clinique court qui fait état de la situation : "le patient présente des symptômes, des signes et des antécédents qui sont compatibles avec l'arachnoïdite adhésive". En résumé, l'IRM devra confirmer le diagnostic d'AA et ne devra pas être considéré comme le seul déterminant du diagnostic. Par exemple, des patients peuvent présenter une agglutination en présence de quelques symptômes ou en l'absence de tout autre symptôme clinique alors que d'autres présenteront des symptômes sévères avec une agglutination douteuse ou marginale.
TRAITEMENT
L'auteur a élaboré un protocole médical ou un traitement pour les cas chroniques qui se compose de 4 éléments : (1) maîtrise et élimination de la neuro-inflammation ; (2) des exercices prévenant la formation d'adhérences ; (3) soulagement de la douleur ; et (4) : protection neuronale et neurogenèse. (Tableau 2). Ce protocole a été développé pour un usage, dans pratiquement toutes les structures de soins, en ambulatoire. L'une des composantes les plus critiques est la suppression et la maîtrise de la neuro-inflammation sinon l'AA va progresser et s'aggraver. L'observation personnelle de l'auteur nous prouve qu'un soulagement stable de la douleur est difficile à obtenir chez les patients atteints d'AA avant qu'un traitement puissant et agressif de la neuro-inflammation soit mis en place. Le traitement neuro-inflammatoire recommandé ici peut, à première vue, apparaître comme présentant des risques non souhaitables mais des tentatives de mises en place d'un traitement moins puissant n'ont pas réussi à entraver la progression de l'AA. Par exemple seulement deux agents anti-inflammatoires traditionnels se sont révélés efficaces dans nos mains: le kérotolac et l'indomethacin. 40,41 Le Kérotolac ne peut pas être utilisé pendant plus de 5 jours consécutifs ou de manière journalière en association avec la pentoxifylline. Ce traitement a été développé en partie en retrouvant dans le sérum des taux de cortisol très faibles, tard dans la journée ou le soir chez les patients atteints d'AA.31 On note également la présence de marqueurs inflammatoires, qui ne diminue pas avec le temps avec la plupart des agents anti-inflammatoires.31 Les études chez les rats ont montré que le corticoïde stéroïdien méthylprédinsolone et l'agent anti-inflammatoire indométhacin suppriment l'inflammation de la queue de cheval et la formation des adhérences.40,41 L'activation micro-gliale et la formation de la neuro-inflammation ont été montrées comme étant chez les rats supprimées par (1) l'acétazolamide ; (2) la mynocycline ; et (3) la pentoxifylline.42-63 L'acétazolamide pourra également réduire la pression du liquide céphalo-rachidien, ceci étant considéré comme un bienfait supplémentaire. A cause des effets secondaires bien connus de l'indométhacin, du kétorolac et des médicaments cortico-stéroïdiens, nous ne recommandons pas une administration journalière mais une administration intermittente dans notre effort pour éviter les effets secondaires tout en empêchant les racines nerveuses de former de nouvelles adhérences et cicatrices, ce qui pourrait provoquer des lésions neurologiques progressives. Une évaluation périodique de la fonction rénale est essentielle avec l'administration du kétorolac et le traitement devra être interrompu, si la fonction rénale est affectée de manière néfaste comme indiqué par un taux élevé de créatinine ou de nitrogène dans l'urée sanguine ainsi que par une réduction du débit de filtration glomérulaire.
La maîtrise de la douleur dans l'AA reste essentiellement la même pour tous les patients souffrant de douleurs irréductibles sévères (voir Tableau 2). Les praticiens possèdent un large choix d'agents neuropathiques, topiques ou opioïdes. A ce stade, l'auteur a vu réussir de nombreux traitements visant à maîtriser la douleur ainsi que de nombreux agents. Le but du soulagement de la douleur, surtout par le biais des opioïdes est de fournir au patient un soulagement de la douleur suffisant pour lui permettre de faire de l'exercice et de marcher quotidiennement, de mener à bien ses activités journalières et d'éviter un état grabataire dans lequel il serait confiné au lit ou au canapé. Les cas sévères peuvent nécessiter une thérapie par opioïdes à forte dose. Dans les cas où les opioïdes n'ont pas été nécessaires, un faible dosage de naltrexone (de 1 à 5 mg par jour) a été efficace. Pour renforcer le soulagement de la douleur et minimiser les opioïdes, l'utilisation de la kétamine, des agents adrénergiques et des anesthésiants topiques ont été aidants.37-39 Un somnifère peut être nécessaire pas seulement pour provoquer le sommeil mais aussi pour aider au drainage lymphatique du système nerveux central. 36
Les exercices sont essentiels pour empêcher les racines nerveuses de la colonne vertébrale de s'agglutiner en formant du tissu cicatriciel et des adhérences, ce qui peut entraîner une paraparésie des extrémités inférieures ou une paralysie. Le message est simple : continuez à vous exercer ou "devenez paralysés". Nous apprenons aux patients à étirer à la fois les extrémités supérieures et inférieures plusieurs fois par jour. L’étirement des jambes vers le haut en les gardant droites et le fléchissement du pied permettront l’étirement des racines nerveuses. Plier les genoux et lever la jambe vers l'abdomen en position allongée ou debout est nécessaire. Marcher à l'extérieur chaque jour est obligatoire. L'immersion dans l'eau est vivement recommandée puisqu'elle permet d'améliorer les étirements et de soulager la douleur. Sauter doucement sur un trampoline ou se balancer sur une chaise apporte du confort et a des chances d'accroître l'écoulement du liquide céphalo-rachidien.
Un certain nombre de mesures sont recommandées pour renforcer, nous l'espérons, la protection neuronale et la neurogenèse (croissance nerveuse) des racines nerveuses endommagées : (1) remplacement des hormones déficientes ; (2) utilisation des neuro- hormones ; la gonadotrophine chorionique humaine et de l'oxytocine ; (3) un régime hautement protéiné et anti-inflammatoire ; (4) de la vitamine B12 ; et (5) la pentoxifylline avec du tocophérol (vitamine E). Les deux concepts de neuro-protection et de neurogenèse sont essentiels pour la prise en charge de l'AA. Malheureusement les racines nerveuses de la queue de cheval sont des cordes anatomiques qui sont librement suspendues dans le liquide. Leur paroi est fragile. Dès lors qu'une inflammation atteint quelques-unes des racines nerveuses, elle apparaît cliniquement comme étant capable de se propager puisque les patients atteints d'AA affirment de manière récurrente que leur état peut s'aggraver suite à un traumatisme additionnel, des procédures médicales comprenant des manipulations physiques, des injections para-spinales et même des infections. Etant donné cette observation clinique, la protection neuronale semble tout aussi importante que l'effort neurogénique entrepris en vue de réparer et de reprendre la croissance des racines nerveuses endommagées et enflammées. La combinaison de la pentoxifylline et de la vitamine E a été rapportée comme dissolvant les cicatrices fibreuses et les adhérences lorsqu'elle est administrée sur une période de plusieurs mois. 64-66 La pentoxifylline n'est pas seulement un inhibiteur des cellules microgliales mais elle est théorisée comme altérant la forme des globules rouges et étant capable d'acheminer la vitamine E à l'intérieur des tissus cicatriciels ou fibreux et éventuellement à même de les dissoudre. Bien que l'usage de la pentoxifylline ait été initié par les médecins français, l'auteur a constaté son efficacité dans quelques cas sélectifs.
TRAITEMENT D’URGENCE POUR L’ARACHNOIDITE AIGUË
L'arachnoïdite peut apparaître de manière aiguë après une seule ponction lombaire, une péridurale, une infiltration épidurale de corticoïdes stéroidiens, une chirurgie, un traumatisme ou une infection virale. Les algologues doivent être conscients de cette possibilité et prêts à fournir un traitement d'urgence pour prévenir une situation d'invalidité ou des lésions sévères. Les patients qui développent une forme aiguë d'arachnoïdite se plaignent d'importantes douleurs dorsales, de faiblesses dans les jambes et de radiculopathie et éventuellement de lésions vésicales en l'espace de 24 h (parfois en l'espace de quelques minutes à une heure) après l'évènement déclencheur. Si le patient consulte après environ 90 jours après l'événement déclencheur, le traitement en urgence est recommandé. Pour l'illustrer, une étude de cas est présentée ici avec à l'intérieur le programme de prise en charge de la douleur chronique de la patiente.
ETUDE DE CAS : Une femme d'origine hispanique âgée de 23 ans, en bonne santé exception faite d'une scoliose, a bénéficié d'une péridurale pour son accouchement. En l'espace de quelques heures après son accouchement, elle a développé des douleurs lombaires sévères, des céphalées et d'importantes difficultés à la marche. Les symptômes ont évolué au cours des 30 jours suivants jusqu'à de fréquents tremblements dans les jambes, une augmentation des difficultés à la marche et en position debout et des difficultés pour uriner. Un IRM a confirmé l'arachnoïdite et elle a été orientée vers l'auteur. L'examen physique a révélé une démarche laborieuse, des réflexes jambiers hypo-actifs et une incapacité à lever les jambes tout en les gardant tendues. Elle commença un traitement de 6 jours à base de méthylprednisolone et une injection de kétorolac (60 mg) pendant trois périodes consécutives de 3 jours. On lui administra de l'hydrocodone, de l'acétaminophen 10 mg toutes les 4 à 6 h pour la douleur et de l'acétazolamide 125 mg par jour et de la minocycline 100 mg deux fois par jour. En l'espace d'une semaine, son état s'était considérablement amélioré. En l'espace de 90 jours, elle a été intégrée dans le protocole médical que l'on décrit dans le tableau 2. Après 9 mois, sa démarche apparaissait comme normale. Elle ressentait quelques douleurs résiduelles et intermittentes et son aptitude à lever les jambes en les gardant tendues était encore quelque peu endommagée. Le traitement spécifique qu'elle suit à l'époque de la rédaction de cet article se compose : (1) méthylprednisolone 4 mg à 15 h cinq jours par semaine ; (2) Kétorolac 30 mg en intra- musculaire chaque lundi ; (3) pentoxyphylline 400 mg deux fois par jour ; (4) oxycodone/ acétaminophène 10 mg, seulement en cas de besoin ; (5) kétamine 25 mg sous la langue si besoin pour le soulagement de la douleur ; et (6) gonadotrophine chorionique humaine de 250 à 500 unités prises 3 fois par semaine. Son IRM (Figure 5) reste anormal. Elle est à même d'occuper un emploi à plein-temps et de s'occuper de ses enfants. Elle sera suivie à vie.
RÉSUMÉ
Les racines nerveuses de la queue de cheval peuvent s'enflammer si elles sont irritées pour quelque raison que ce soit y compris les toxines, les infections, les traumatismes ou les frictions entre racines. Les causes de déclenchement de l'irritation les plus courantes sont probablement les hernies discales qui compriment les racines nerveuses. Des articulations endommagées par l'arthrite, un traumatisme ou une scoliose à l'origine de frictions entre quelques racines nerveuses ou de la compression de celles-ci peuvent provoquer l'AA. Les traitements médicaux nécessaires pour traiter les anomalies dorsales pathologiques peuvent accélérer ou potentiellement déclencher un processus neuro-inflammatoire à l'intérieur des racines nerveuses de la queue de cheval. L'AA paraît augmenter en termes de prévalence et des cas apparaissent maintenant dans tous les Etats-Unis. Les patients qu'on étiquette comme souffrant du "syndrome de l'échec d'une chirurgie dorsale" sans aucun doute présentent une certaine prévalence d'AA comme processus causal et ses patients devraient être évalués pour la présence d'AA. La douleur provoquée par l'AA peut être profonde et tout patient qui se plaint en exprimant des douleurs dorsales sévères, nécessite un traitement analgésique supérieur à la norme et ceux qui se plaignent de para parésie, d'incapacité à tenir debout, de vision trouble, de brûlures plantaires et de dysfonctionnements intestinaux et vésicaux, doivent être suspectés de présenter un cas d'AA et doivent être dépistés en ce sens. Le diagnostic d'AA se fait par les antécédents, un examen physique et un IRM de confirmation. Le traitement doit se concentrer sur la maîtrise de la neuro-inflammation puisqu'elle est la cause sous-jacente de la douleur, du handicap et de l'évolution de la pathologie. Les protocoles médicaux pour des formes aiguës ou chroniques d'AA ont été mis au point et sont publiés ici pour être utilisés dans des structures de soin ambulatoires. Un traitement agressif doit être débuté dès que l'on suspecte la présence d'arachnoïdite pour stopper ou ralentir sa nature progressivement invalidante.
Références
-
O’Callgan JP, SriranT, Miller DB. Defining “neuroinflammation”. Ann NY Acad Sci 2008;1139:318-330.
-
Aldrete JA. Suspecting and diagnosing arachnoiditis. Pract Pain Mgt 2006;6(1):72-82.
-
Tennant F. Adhesive Arachnoiditis. Pract Pain Mgt 2014;14(7):63-69.
-
Nakano M, Matsui H, Miaki K, et al. Post-laminectomy adhesion of the cauda equina: changes of postoperative vascular permeability of the equina of rats. Spine 1996;22(10):1105-1114.
-
Ross JS, Masaryk TJ, Modic MT, et al. MR imaging of lumbar arachnoiditis. AJB 1987;149:1025-1032.
-
Avidan A, Gomori M, Davidson E. Nerve root inflammation demonstrated by magnetic resonance imaging in a patient with transient neurologic symptoms after intrathecal injection of lidocaine. Anesthesiology 2002;97(1):257-258.
-
Quiles M, Marchicello PJ, Tsairis P. Lumbar adhesive arachnoiditis: etiologic and pathologic aspects. Spine 1978;3:45-50.
-
Jorgensen J, Hartzen PH, Steenakrov V, et al. A clinical and radiological study of chronic lower spinal arachnoiditis.
Neuroradiology 1975;9:139-144.
-
Delamarter RB, Ross JS, Masaryk TJ, et al. Diagnosis of lumbar arachnoiditis by magnetic resonance imaging. Spine 1990;15:304- 310.
-
Shaw MDM, Russel JA, Grossart KW. The changing pattern of spinal arachnoiditis. J Neurol Neruosurg Psychiatry 1978;41:97- 107.
-
Monij JA. Spinal arachnoiditis disease or coincidence? Acta Neuroclir 1980;53:151-160.
-
Kumar A, Montanero W, Wilinsky R, et al. MR features of tubercular arachnoiditis. J Comput Assist Tromog 1993;17:127-130.
-
Burton CV. Lumbrosacral arachnoiditis. Spine 1978;3:24-30.
-
Aldrete JA. Nerve root “irritation” or inflammation diagnosed by magnetic resonance imaging. Anesthesiology 2003;98(5):1294.
-
Matsui H, Tsuji H, Kanamori M, et al. Laminectomy-induced arachnoiditis: a postoperative serial MRI study. Neurored
1995;37:660-666.
-
Jorgensen J, Hansen PH, Steenskov V, et al. A clinical and radiological study of chronic lower spinal arachnoiditis. Neuroradiology
1975;9:139-144.
-
Bonner B, Ehni G. Spinal arachnoiditis: the post-operative variety in particular. Spine 1978;3:40-44.
-
Cohen MS, Wall EJ, Kerber CW, et al. The anatomy of the cauda equina on CT scans and MRI. J Bone Joint Surg 1991;73-B:381- 384.
-
Well EJ, Cohen MS, Massic JB, et al. Cauda equina anatomy: intrathecal nerve root organization. Spine 1990;15:1244-1247.
-
Johanson CE, et al. Multiplicity of cerebrospinal fluid functions: new challenges in health and disease. Cerebrospinal Fluid Res
2008;5:10.
-
Weller RO, Djuanda E, Yow H, et al. Lymphatic drainage of the brain and the pathophysiology of neurological disease. Acta Neuropathol 2009;117:1-14.
-
Csarr HF, Harling-Berg CJ, Knopf PM. Drainage of brain extracellular fluid into blood and deep cervical lymph and its immunological significance. Brain Path1992;2:259-296.
-
Laman JD, Weller RO. Drainage of cells and soluble antigen from the CNS to regional lymph nodes. J Neuroimmune Pharmacol
2013;8:840-856.
-
Rydovik B, Holm S, Brown MD, et al. Diffusion from the cerebrospinal fluid as a nutritional pathway for spinal nerve roots. Acta Physiol Scand 1990;138:247-248.
-
Haughton VM, Eldavis OP, Ho KC, et al. Arachnoiditis from experimental myelograph with aqueous contrast media. Spine
1978;3:65-69.
-
Hoagland JA, Freemont AJ, Denton J, et al. Retained surgical swab debris in post laminectomy arachnoiditis and peridural fibrosis.
J Bone Joint Surg (BR) 1988;70-B:659-662.
-
Tsuda M. Microglia in the spinal cord and neuropathic pain. J Diabetes Investig 2016;7(1):17-26.
-
Streit WJ, Mack RE, Griffin WS. Microglia and neuroinflammation: a pathologic perspective. J Neuroinflammation 2004;1:14-19.
-
Graeber MB. Changing face of microglia. Science. 2010;330(6005):783-788.
-
Tennant F. Which chronic back pain patients have arachnoiditis. J Pain 2016;17(4):532.
-
Tennant F. Search for inflammatory markers in centralized, intractable pain. Presented at: American Academy of Pain Management. September 2013;Orlando, Florida.
-
Tennant F. Erythrocyte sedimentation rate and C-reactive protein: old but useful biomarkers for pain treatment. Pract Pain Manag. 2013;13(2):61-65.
-
Benoliel R, Tal M, Eliav E. Effects of topiramate on the chronic constriction injury model in the rat. J Pain 2006;7:878-883. (Pub Med: 17157773)
-
Obong MS, Libretto SE. The rationale and use of topiramate for treating neuropathic pain. Clin J Pain 2003;19:59-68. (Pub Med: 12514458)
-
Khoromi S, Patsalides A, Parada S, et al. Topiramate in chronic lumbar radicular pain. J Pain 2005;6:829-836. (Pub Med: 16326371)
-
Xle I, et al. Sleep drives metabolite clearance from the adult brain. Science 2013;342:373-377.
-
Drago F, Caccamo G, Continella G, et al. Amphetamine-induced analgesia does not involve brain opioids. Eur J Pharmacol 1984; 101(3-4):267-9.
-
Wang R, King T, DeFelcie M, Guo W, Ossipov MH, Porreca F. Descending facilitation maintains long-term spontaneous neuropathic pain. J Pain. 2013;14(8):845-853.
-
Grande L, Delacrue H, Thompson G, et al. Oral ketamine for chronic pain: a 32-subject placebo-controlled trial in patients on chronic opioids. J Pain 2016;17(4):5149.
-
Aldrete JA. Epidural injections of indomethacin for post-laminectomy syndrome: a preliminary report. Anesth Anal 2003;96(2):463- 468.
-
Nakano M, Matsui H, Miaki K, et al. Post-laminectomy adhesion of the cauda equina: inhibitory effects of anti-inflammatory drugs on cauda equina adhesion in rate. Spine 1998;23(3):298-304.
-
Tawfik VL, Nutile-McMenemy N, Lacroix-Fralish MI, et al. Efficacy of propentofylline, a glial modulating agent, on existing mechanical allodynia following peripheral nerve injury. Brain Behav Immun 2007;21:238-246.
-
Dorazil-Dudzik M, Mika J, Schafer MK, et al. The effects of local pentoxifylline and propentofylline treatment on formula-induced pain and tumor necrosis factor-alpha messenger RNA levels in the inflamed tissue of the rat paw. Anesth Analg 2004;98:1566-1573.
-
Tikka TM, Kaistinaha JE. Minocycline provides neuroprotection against n-methyl-d-asparate neurotoxicity by inhibiting microglia.
J Immunol 66:7527=7533.
-
Mika J. Modulation of microglia can attenuate neuropathic pain symptoms and enhance morphine effectiveness. Pharmacol Rep
2008;60:297-300.
-
Hutchinson MR, Northcutt AL, Chao LW, et al. Minocycline suppresses morphine-induced respiratory depression, suppresses morphine-induced reward, and enhances systemic morphine-induced analgesia. Brain Behav Immun 2008;22:1248-1256.
-
Cui Y, Liao XX, Liu W, et al. A novel role of minocycline attenuating morphine antinociceptive tolerance by inhibition of p38 MAPK in the activated spinal microglia. Brain Behav Immun 2008;22:114-123.
-
Raghavendra V, Tanga FY, DeLep JA, et al. Attenuation of morphine tolerance, withdrawal-induced hyperalgesia, and associated spinal inflammatory immune responses by propentofylline in rat. Neuropsychopharmacology 2004;29:327-334.
-
Radhakrishnan R, Sluka KA. Acetazolamide, a carbonic anhydrase inhibitor, reverses inflammation-induced thermal hyperalgesia in rats. J Pharmacol Exp Ther 2005;313:921-927.
-
Supuran CT. Carbonic anhydrases: novel therapeutic applications for inhibitors and activators. Nat Rev Drug Discov 2008;7:168- 181.
-
Harvey JW, Otterson M, Yun H, et al. Acetazolamide reduces referred postoperative pain after laparoswcopic surgery with carbon dioxide insufflation. Anesthesiology 2003;99:924-928.)
-
Liu J, Feng X, Yu M, et al. Pentoxifylline attenuates the development of hyperalgesia in a rat model of neuropathic pain Neurosci Lett 2007;412:268-272.
-
Vale ML, Benevides VM, Sachs D, et al. Antihyperalgesic effect of pentoxifylline on experimental inflammatory pain. Br J Pharmacol 2004;143:833-844.
-
Sweitzer SM, Schubert P, DeLeo JA. Propentofylline, a glial modulating agent, exhibits antiallodynic properties in a rat model of neuropathic pain. J Pharmacol Exp Ther 2001;297:1210-1217.
-
Asiedu M, Ossipov MHG, Kaila K, et al. Acetazolamide and midazolam act synergistically to inhibit neuropathic pain. Pain
2010;148(2):302-308.
-
Pi R, Wenning L, Nelson TK, et al. Minocycline prevents glutamate-induced apoptosis of cerebellar granule neurons by differential regulation of p38 and akt pathways. J Neurochem 2004;91:1219-1230.
-
Tikka T, Usenius T, Tenhunon M, et al. Tetracycline derivatives and ceftriaxone, a cephalospaorin antibiotic, protect neurons against apoptosis induced by ionizing radiation. J Neurochem 2001;78:1409-1414.
-
Kraces RL, Pasieczny R, Larioso-Willingham, et al. Antioxidant properties of minocycline: neuroprotection in an oxidative stress assay and direct radical-scavenging activity. J Neruochem 2005;94:819-827.
-
Kelso Ml, Schef NN, Scheff SW, et al. Melatonin and minocycline for combinatorial therapy to improve functional and histopathological deficits following traumatic brain injury. Neurosci Leh 2011;488(1):60-64.
-
Pabreja K, Dua K, Sharma S, et al. Minocycline attenuates the development of diabetic neuropathic pain: possible anti-inflammatory and anti-oxidant mechanism. Eur J Pharmacol 2011;661(1-3):15-21.
-
Chew DJ, Carlstedt T, Shortland PJ. The effects of minocycline or riluzole treatment on spinal root avulsion-induced pain in adult rate. J Pain 2014;15(6):664-675.
-
Liu J, Li W, Zhu J, et al. The effect of pentoxifylline on existing hypersensitivity in a rat model of neuropathy. Anaesth Analog
2008;106:650-653.
-
Singh R, Sen I, Wig J, et al. An acetazolamide based multimodal analgesic approach versus conventional pain management in patients undergoing laparoscopic living donor. Indian J Anaesth 2009;53(4):434-441.
-
George C, Lefain JL, Delonion S. Case reort: resolution of symptomatic epidural fibrosis following treatment with combined pentoxifylline-tocopherol. Br J Radiol 2004;77:885-887.
-
Delanian S, Porcher R, Balla-Mekias S, et al. Randomized placebo-controlled trial of combined pentoxifylline and tocopherol for regression of superficial radiation-induced fibrosis. J Clin Oncol 2003;21:2545-2550.
-
Lefaix JL, Delanizan S, Vozenin MC, et al. Striking regression of subcutaneous fibrosis induced by high doses of gamma rays using a combination of pentoxifylline and alpha-tocopherol: an experimental study. Int J Radiat Oncol Biol Phys 1999;43:839-847.
-
TABLEAU 1
SYMPTÔMES ET SIGNES COURANTS D’ ARACHNOÏDITE
SYMPTÔMES
-
Douleur constante
-
Douleur et faiblesse en position debout prolongée : doit s'asseoir ou s'allonger
-
Sursauts / tremblements dans les jambes
-
Difficulté à démarrer la miction et / ou la défécation
-
Épisodes intenses de bouffées de chaleur / Transpiration
-
Pieds brûlants
-
Épisodes de vision trouble
SIGNES
-
Ne peut pas lever les jambes en les gardant tendues
-
Diminution de l'amplitude dans les extrémités supérieures et inférieures
-
Faiblesses dans les jambes
-
Hyporéflexie dans les jambes
-
Démarche anormale : lente hésitante, à petits pas ou penchée
-
Asymétrie de la musculature dorsale
TABLEAU 2
PROTOCOLE MEDICAL DE L’AUTEUR POUR L’ARACHNOIDITE CHRONIQUE
-
MAÎTRISE DE LA NEURO-INFLAMMATION
A. Méthylprednisolone 4 à 8 mg PO ou Prednisone 5 à 10 mg PO (Prendre à 3 h de l’après-midi sur 3 à 5 jours/semaine
B. Kétorolac (Toradol ®) en injections Intra-Musculaires, 30-60 mg 1 fois /semaine
C. L’un des remèdes suivants: 40-63
1. Acétozolamide (Diamox ®), 75 à 250 mg/jour 2. Pentoxifylline (Trental ®), 400 à 800 mg/jour 3. Minocycline, 100 à 200 mg/jour 4. Indométhacin (Indocin ®), 25 à 50 mg PO au cours des repas, 3 à 5 jours/semaine
-
EXERCICES POUR PRÉVENIR LA FORMATION D’ADHÉRENCES
-
Étirements et amplitude des deux extrémités
-
Marches journalières
-
Flexions du pied
-
Lever les jambes en les gardant tendues
-
Plier les genoux
-
OPTIONS : immersion dans l'eau, trampoline, chaise à bascule
3. SOULAGEMENT DE LA DOULEUR Utilisez des agents de catégories multiples pour une réponse optimale (Choix du praticien).
-
Agents neuropathiques L'un des agents suivants : gabapentin, pregabalin , baclofène, duloxetine, Carisoprodal, diazepam, tizanidine, topiramate 33-35
-
N-méthyl-D-antagoniste de l'asparthate
L'un des suivants : Kétamine 15 à 25 mg per os (= par voie orale) ou par voie sublinguale deux fois par jour ou quatre fois par jour, dextromethorphan 30-60 mg par jour ou prégnénolone 50 à 100 mg par jour.
-
Opioïdes : Tous ceux qui sont cliniquement disponibles, administrés par quelque voie que ce soit ou à quelque dose que ce soit, qui apporte un soulagement de la douleur assez important pour réaliser des exercices, mener à bien les tâches de la vie quotidienne et minimiser les périodes pendant lesquelles le patient est rivé au lit ou au canapé. Les opioïdes injectables ou du fentanyl administré sous les muqueuses sont souvent nécessaires pour le traitement des accès douloureux.
-
Somnifère
-
Analgésiques topiques
Un ou deux des médicaments suivants ou selon les choix des praticiens : lidocaine, morphine, carisoprodol, prednisone
-
Agents adrénergiques37,38
L'un des médicaments suivants : Méthylphenidate, dextroamphétamine, sels d'amphétamine, phentermine
4. NEUROPROTECTION ET NEUROGENESE
-
Substitution hormonale de toute déficience sérique en termes de cortisol, DHEA, prégnénolone, progestérone, œstradiol, thyroïde, testostérone, Vitamine D
-
Vitamine B12 - Les autres nutriments sont laissés au choix du praticien
-
Régime hautement protéiné et anti-inflammatoire
-
Neurohormones : gonadotrophine chorionique humaine 500 unités 3 jours /semaine et /ou oxytocine, 20-40 unités 3 jours/semaine
-
Pentoxifylline 400-800 mg par jour avec vitamine E – 500-1000 mg par jour
Les doses listées sont les doses de démarrage. Tous les éléments ne sont pas habituellement nécessaires pour une prise en charge clinique efficace des cas chroniques.
Tableau 3
PROTOCOLE MÉDICAL DE L’AUTEUR POUR LES TRAITEMENTS D’URGENCE DE L’ARACHNOIDITE
1. Méthylprednisolone 4 mg, pack de doses pour 6 jours de traitement
2. Kétorolac 60 mg en intramusculaire pendant 3 à 4 jours consécutifs
3. Minocycline 100 mg deux fois par jour
4. Acétazolamide de 75 à 250 mg par jour
5. Le soulagement de la douleur se fait grâce aux opioïdes et aux agents neuropathiques laissés au libre choix du praticien. La sélection précise des agents peut varier tant que le patient bénéficie d'un soulagement de sa douleur assez prolongé pour s'exercer et marcher 4 à 6 fois par jour.
6. Lever les jambes en les gardant tendues et lever les genoux 4 à 6 fois par jour
7. Trampoline, marche et/ou chaise à bascule 5 minutes deux fois par jour
OPTIONS: peut augmenter le dosage de methylprednisolone en utilisant les injections ou l'administration par voie orale. Si aucun résultat n'est apparent, passez à un traitement à base de prednisone 40 à 60 mg par jour pendant 5 jours. Un traitement puissant à base de crème topique à la prednisone (30 mg par once) sur la zone douloureuse peut être diffusé aux alentours ou potentiellement à l'intérieur de la zone enflammée par le biais de la radiofréquence ou d'outils électromagnétiques. (Provant®, Regenesis Inc., Scottsdale, AZ)
NOTE SPÉCIFIQUE : Le but majeur d'un traitement d'urgence est de prévenir le développement d'une douleur incoercible, d'une paralysie ou d'une para-parésie des extrémités inférieures et de troubles vésicaux ou intestinaux. Une marche constante ou la pratique d'exercices mettant en jeu les jambes restent probablement essentielles pour prévenir la formation des adhérences à l'intérieur de la queue de cheval.
Article Arachnoïdite et Kystes méningés "injection de sang dans l'espace sous Arachnoïdien"
http://association-amtas.e-monsite.com/medias/files/arachnoidite-et-kystes-meninges.pdf
Article d'Arachnoïdite adhésive après traitement percutané de colle de fibrine d'un kyste méningé sacré:
Arachnoïdite adhésive après traitement percutané de colle de fibrine d'un kyste
méningé sacré.
Auteur :
J Neurosurg Spine4 avril 2014
Hayashi K, Nagano, S. Hattori
Résumé
Les auteurs présentent le cas d'une femme de 64 ans qui a été renvoyé pour la douleur sacrée sévère.
Elle a indiqué que sa douleur avait été de longue date, et a considérablement augmenté après un traitement de
placement fibrine percutanée de colle pour un kyste méningé sacré deux mois plus tôt dans un autre
hôpital.
Une IRM obtenue immédiatement après le placement de la colle de fibrine à l'hôpital a suggéré que la colle de fibrine a migré supérieurement dans l'espace sous-arachnoïdien du kyste du sacrum au niveau de la L-4. Lors de son admission dans un établissement pour les auteurs, l'examen physique n'a révélé aucune anomalie, sauf pour hypoesthésie péri-anale. Une étude IRM obtenue à l'admission a montré une lésion kystique dans l'espace péridural à partir du niveau de S-2, S-4. Intensité homogène a été identifié dans cette région sur les images pondérées en T2.
Parce que la queue de cheval et les racines nerveuses semblent être comprimées par la lésion, l'excision du kyste totale a été effectuée. La cavité du kyste a été rempli de liquide qui ressemblait au LCR, mais plus gélatineux.
L'examen histopathologique a révélé que la paroi du kyste est composé de tissu conjonctif hyalin avec une certaine calcification. Aucune cellule ou ganglion nerveux ont été trouvés dans le tissu. La matière gélatineuse était acellulaire, et semblait dégénérer la colle de fibrine. La douleur sacrée a persisté dans une certaine mesure après la chirurgie. Les auteurs présumés de la colle de fibrine migrée ont provoqué le développement de l'arachnoïdite adhésive . Le risque d' arachnoïdite adhésive doit être envisagée lorsque cette thérapie est prévue.
La communication entre un kyste et l'espace sous-arachnoïdien doit être confirmé pour êtresuffisamment étroite pour empêcher la migration de la colle de fibrine injectée.
Article "la vie avec l'Arachnoïdite"
http://association-amtas.e-monsite.com/medias/files/article-la-vie-avec-l-arachnoi-dite.pdf
